בואו להשפיע עוד היום
"מגזין זמן אמת" הוא אתר תקשורת שהוקם כדי לספק את מה שחסר כל כך במדיה – עיתונות אחרת, מעמיקה, המייצרת תוכן איכותי, שכולל תחקירים, סקירות ומאמרי עומק, ופועלת מתוך תחושת שליחות וללא אינטרסים מסחריים או פוליטיים, בתמיכת הציבור הרחב.
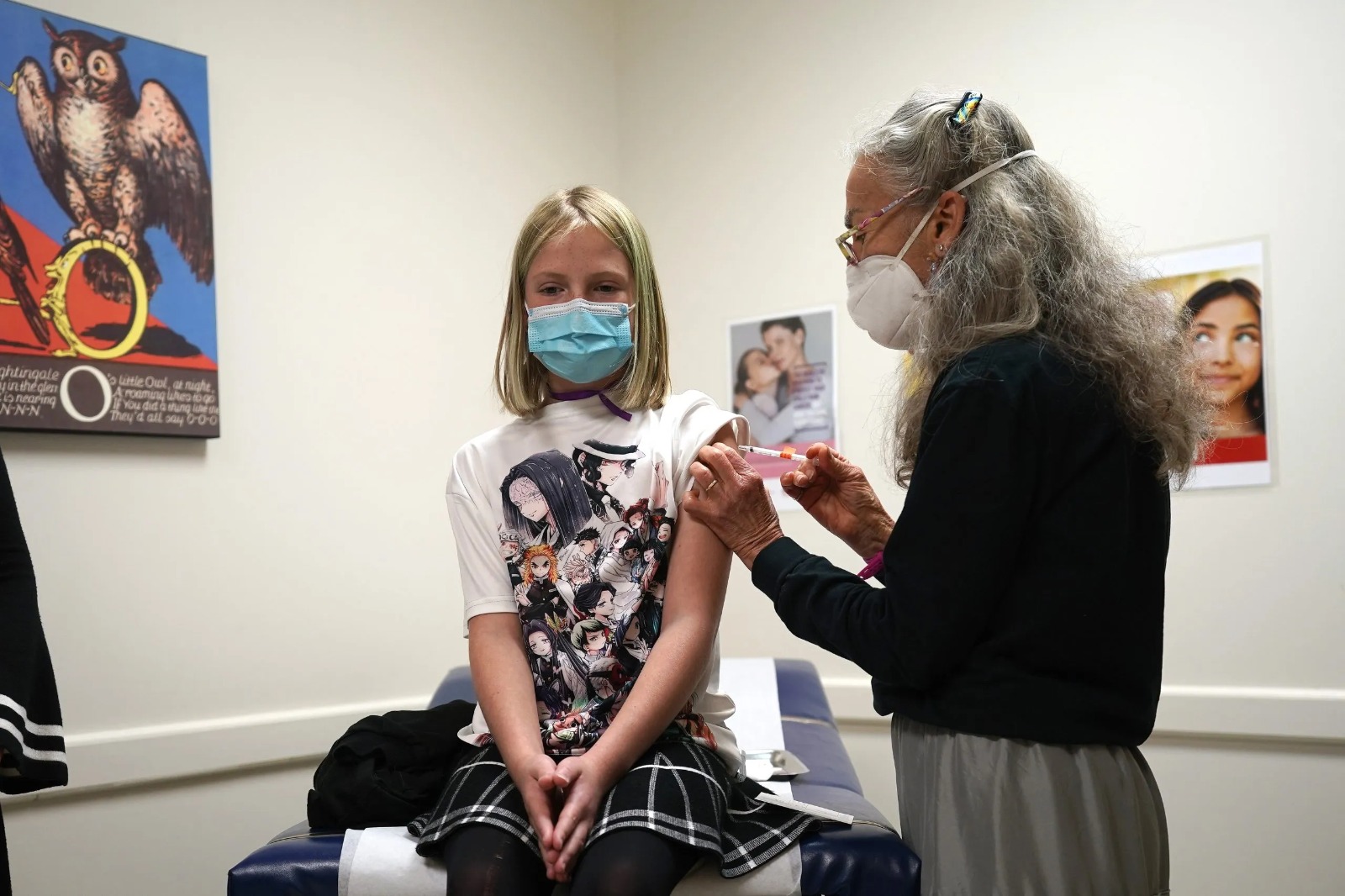
חשיפה: פורמולת החיסון של פייזר עבור בני 5-11 שוּנתה, אך הפורמולה החדשה לא נבדקה במחקרים קליניים
הפורמולה החדשה שנועדה לילדים שונה מהקודמת לא רק במינון, אלא גם בהרכב, אך למרות זאת לא נבדקה במחקרים קליניים. המחקר בילדים בוצע בפורמולה הקודמת. ה-FDA לא דרש מהחברה לבצע מחקרים בילדים, במבוגרים, או אפילו בחיות. ד"ר אריק רובין, עורך ה-New England Journal of Medicine: "לעולם לא נלמד עד כמה החיסון בטוח עד שנתחיל לתת אותו"

הרכב החיסון של פייזר עבור ילדים בגילאי 5-11 יהיה שונה מזה שניתן כיום לבני 12 ומעלה, כאשר השינוי מתבטא לא רק במינון, שהוקטן מ-30 מיקרוגרם למנת חיסון ל-10 מיקרוגרם, אלא בהרכב החיסון עצמו. אף על פי כן, החברה לא ביצעה מחקרים קליניים בהרכב החדש, וה-FDA לא דרש ממנה כלל לבצע מחקרים כאלה לפני שאישר את הרחבת היתר החירום גם לילדים הצעירים - לא בילדים ולא במבוגרים, ואפילו לא מחקרים בחיות. כך עולה מהדיון בוועדה המייעצת של ה-FDA בסוגיית ההרחבה של היתר החירום של חיסון פייזר עבור הילדים הצעירים שהתקיים ב-26 באוקטובר, וכן ממסמך הסקירה של הנתונים הקליניים שהגישה החברה ל-FDA לצורך בקשת היתר החירום בילדים, ואשר התפרסם במקביל לדיון.
בדיון בוועדה המייעצת של ה-FDA טענו נציגי החברה שהשינוי בהרכב הפורמולציה הינו "שינוי מינורי", והסבירו שמדובר במרכיב שנקרא תרומטמין (Tris), שנועד לשפר את יציבות החיסון ולהאריך את חיי המדף שלו. "ברור שהיו לנו התייעצויות נרחבות עם ה-FDA, והוחלט שהמחקרים הקליניים אינם נחוצים", אמר ד"ר וויליאם גרובר, סגן נשיא למחקר ופיתוח קליני בחטיבת החיסונים בפייזר. השינוי בהרכב צוין גם במסמך שהוגש ל-FDA לפני הדיון, בפרק העוסק בהרכב החיסון.
 |
| המחקר בילדים בוצע בפורמולה הקודמת |
למעשה, העובדה שהפורמולציה השתנתה התפרסמה במספר כלי תקשורת גדולים בחו"ל עוד לפני הדיון בוועדה המייעצת של רשות התרופות האמריקנית. ד"ר תרזה טאם, האחראית על בריאות הציבור בקנדה, אמרה בתדרוך לעיתונאים שנערך ב-15 באוקטובר שהשינוי בחיסון הילדים לא יסתכם רק במתן מינון קטן יותר של החיסונים שכבר נאגרו בקנדה. "אנחנו גם מבינים מפייזר שהפורמולציה עצמה השתנתה, זוהי פורמולציה של הדור הבא, אז זה משהו שיצטרך להיבחן על ידי הרגולטור", היא אמרה. למרות ההכרזה הדרמטית, ד"ר טאם לא הבהירה במה יתבטא השינוי, ואף אחד מכלי התקשורת שפרסם את הידיעה לא העלה את השאלה.
 |
| במסמך שהוגש ל-FDA לפני הדיון צוין המרכיב tromethamine. החברה הסבירה שהוא נועד לשפר את יציבות התכשיר ולהאריך את חיי המדף שלו. |
שינוי מינורי?
לאחר הדיון ב-FDA הוצפו הרשתות החברתיות בגל של פרסומים מודאגים ביחס למרכיב הזה, שכן ה-Tris משמש כתרופה הניתנת כטיפול נמרץ במקרים של התקף לב כתוצאה מחמצת מטבולית חמורה (מצב שבו ישנה חומציות מוגברת של הדם ושל נוזלי הגוף, כתוצאה מפגיעה בריאות או בכליות, או בשל מחלות שונות), וכן בהליכים רפואיים כמו ניתוחי מעקפים. שתי טענות הועלו בהקשר הזה. האחת, שהסיבה האמיתית להכנסת ה-Tris לחיסון היא כדי למנוע התקפי לב כתוצאה מחמצת מטבולית חמורה שעלולה להיגרם בעקבות החיסון, בשל שינוי במאזן האלקטרוליטים בדם, ומכאן – שבפייזר מודעים לעובדה שהחיסון עלול לגרום לתופעה זו. הטענה השנייה היא שהחומר עצמו עלול להיות מסוכן לילדים, שכן תופעות הלוואי הידועות שלו כוללות בין היתר, דיכוי של דרכי הנשימה, דלקת ברקמות, פקקת עורקים, ירידה ברמות הסוכר בדם, סיכון לנמק ועוד. יתירה מכך, דף התרופה של התרומטמין מבהיר כי יש להשתמש בחומר בזהירות בילדים.
בודקי העובדות ברשת, וגם משרד הבריאות, מיהרו לפרסם בתגובה שמדובר ב"פייק ניוז", וכי לא נעשו שינויים במרכיבי החיסון הפעילים, דהיינו ה-mRNA וחלקיקי הננו השומניים העוטפים אותו (LNPs), וגם תהליכי הייצור נותרו ללא שינוי.
אז מה נכון ומה לא נכון בסיפור הזה?
ד"ר דיוויד וייסמן, מומחה לפתולוגיה ניסויית וחבר באגודה המלכותית הפרמצויטית בבריטניה, ששימש במשך שנים רבות כחוקר בכיר בחברת ג'ונסון & גו'נסון וכיום משמש כיועץ לחברות ביחס לביצוע מחקרים קליניים לצורך קבלת אישור FDA, ושהיה אחד מהמומחים שהציגו את עמדתם בדיון במתן היתר חירום לחיסוני הילדים הצעירים שהתקיים על ידי משרד הבריאות ביום חמישי האחרון (ה-4 בנובמבר), בחן לעומק את הסוגיה. בראיון ל"חדשות זמן אמת" הוא מסביר מדוע ההחלטה של פייזר לשנות את ההרכב מדאיגה ביחס לסיכונים שעלולים להיגרם לילדים, גם אם השינוי בהרכב הפורמולציה נעשה רק במרכיב הבאפר, ואף מספקת הוכחה לאופי הניסיוני של החיסונים.
"איננו יודעים מאומה על השפעת החיסון בהרכב החדש", אומר ד"ר דיוויד וייסמן, מומחה לפתולוגיה ניסויית ויועץ לחברות בביצוע מחקרים קליניים לקבלת אישור FDA.
"כמעט כל תכשיר רפואי חייב לכלול מרכיב שנקרא באפר (בתרגום מילולי "חוצץ"), שהוא תמיסה שתפקידה לשמור על האיזון בין המלחים החומציים והאלקליים בתכשיר", הוא אומר. "יש למרכיב הזה חשיבות רבה, משום שחייבים לשמור על האיזון בטווח צר. אסור שלתכשיר תהיה חומציות רבה מדי או אלקליות רבה מדי. הבאפר שבו החברה השתמשה עד כה בחיסונים של בני ה-12 ומעלה נקרא PBS. הטענה שאנשי פייזר העלו במהלך הדיון בוועדה המייעצת של ה-FDA כשנשאלו על השינוי בהרכב התכשיר הייתה שהשינוי הזה נעשה כדי לשפר את יציבות החיסון ואת חיי המדף שלו. זו טענה שנשמעת הגיונית. אנחנו יודעים שהחיסון של פייזר חייב להישמר בטמפרטורה נמוכה מאוד, של מינוס 70 מעלות צלזיוס, מה שהופך את הלוגיסטיקה של השימוש בו למסובכת ויקרה מאוד. השינוע של החיסון, תנאי האחסון שלו לפני ואחרי שהוא מגיע למרכזי החיסונים, למרפאות, לבסיסים הצבאיים שבהם הוא ניתן, הטמפרטורה שבה הוא נשמר אחרי שפותחים את האצוות - לכל אלה יש חשיבות רבה. אחת ההשלכות הפוטנציאליות של היעדר יציבות מספקת של החיסון, היא שכאשר פותחים אצוות חיסונים במרכז חיסונים, האדם שמקבל בסוף היום את החיסון האחרון ככל הנראה לא מקבל את אותו מינון של mRNA כמו האדם שמקבל את החיסון ראשון ב-8:00 בבוקר, כשהאחות הוציאה את האצווה מהמקפיא. הסיבה לכך היא שמולקולות ה-mRNA נהרסות ונשברות כעבור זמן מה כשהתכשיר נמצא מחוץ למקפיא, בטמפרטורת החדר. לכן, בפייזר מודאגים עד כמה המוצר עדיין יעיל בסוף היום – האם המינון של 30 מיקרוגרם mRNA שהיה במנה שקיבל המחוסן הראשון, הוא עדיין 30 מיקרוגרם בסוף היום, או שמא הוא ירד ל-20 מיקרוגרם, או ל-15 מיקרוגרם, ואז אולי הוא פחות יעיל? גם חיי המדף של החיסון שלהם לא ארוכה. הוא פג תוקף מהר מאוד. לכן, ברור שהם רוצים לשפר את חיי המדף ואת היציבות, וזה הגיוני לנסות לפתח מוצר שיהיו לו דרישות אחסון טובות יותר. כדי להשיג את השיפור, החברה החליטה לשנות את הבאפר, וגם זו החלטה שנשמעת הגיונית. ישנם סוגים רבים של באפרים, והם החליטו להשתמש ב-Tris".
לדברי ד"ר וייסמן, באופן עקרוני, הוא אינו סבור שה-Tris כשלעצמו מסוכן. "ה-Tris משמש כבאפר גם בתכשירים רפואיים אחרים, והמינון שלו בחיסון הוא נמוך מאוד". לשם השוואה, המינון שמשמש לטיפול בחמצת מטבולית הוא 13.9 גרם, ואילו המינון במנת חיסון המיועדת לילדים היא בערך 0.3 מיליגרם. כלומר, מינון הקטן פי 42 אלף בערך מהמינון הטיפולי. למה בכל זאת אני מודאג? בגלל שתי בעיות. ראשית, ליציבות המשופרת של החיסון יכולות להיות השלכות לא רק על היעילות, אלא גם על בטיחות החיסון. הבעיה היא שההשלכות האלה אינן ידועות. האם שיפור היציבות, כך שיהיה פחות הרס של מולקולת ה-mRNA, יוביל להגדלה או דווקא להקטנה של הסיכון לתופעות לוואי? האם במקרה כזה, לאדם שיקבל את החיסון בסוף היום יהיו פחות תופעות לוואי לעומת זה שהתחסן בתחילת היום? התשובה היא שאיננו יודעים. מצד אחד, אם ה-mRNA הוא זה שגורם לתופעות הלוואי, הרי שאם התחסנת בסוף היום וקיבלת מינון קטן יותר, כנראה שיהיו לך פחות תופעות לוואי. מצד שני, ייתכן שדווקא השבירה וההרס של המולקולה הופכים אותה ליותר מסוכנת וגורמים ליותר תופעות לוואי. מהי התשובה הנכונה? איננו יודעים. אנחנו לא יודעים האם שיפור היציבות יגרום לכך שהחיסון יהיה בטוח יותר, או דווקא מסוכן יותר. אילו היינו יכולים לקבל נתונים במערכת ה-VAERS שיאפשרו לעשות הצלבה בין השעות שבהן ניתן החיסון במהלך היום לבין תופעות הלוואי, היינו יכולים אולי לקבל תמונה טובה יותר. הבעיה היא שאין לנו אפשרות כזו. זה מידע מאוד בסיסי שאנחנו חייבים לדעת, והוא אינו בידינו".
אינטראקציה לא רצויה עם חלקיקי הננו
הבעיה השנייה, לדבריו, כרוכה בעובדה שהבאפר עלול ליצור אינטראקציה בלתי רצויה עם חלקיקי הננו השומניים (LNPs) שנמצאים בחיסון. "ה-LNPs, חלקיקי ננו השומניים, עוטפים את מולקולת ה-mRNA. הם מגינים עליה מפני התפרקות, ובו בזמן עוזרים לה לחדור לתוך התאים, והם מושפעים מאוד מסביבתם. למשל, מרמת ה-pH. החשש שלי הוא שאם תיווצר אינטראקציה בין הבאפר החדש הזה לבין החלקיקים הללו, איננו יודעים כיצד זה ישפיע על ההתנהגות שלהם – כלומר על האופן שבו הם מופצים בגוף, או על הדרך שבה הם עצמם מקיימים אינטראקציה עם התאים וחודרים אליהם. אם חלקיקי הננו העוטפים את ה-mRNA ינועו בגוף בצורה שונה, זה יכול לשנות את היעילות ואת הבטיחות שלהם. זה יכול להיות יעיל יותר או פחות, בטוח יותר או פחות. אולי זה הופך את המולקולה שנשברה לרעילה ואולי לא. אנחנו לא יודעים".
- האם יש דרך לבדוק את זה?
"הדרך לבדוק את זה היא באמצעות מחקרים, וזה למעשה הסטנדרט. כאשר חברה רוצה לעשות שינוי במוצר רפואי, אפילו כשמדובר במשהו מאוד מאוד פשוט, היא חייבת ללכת ל-FDA ולהצהיר שהיא מבקשת לעשות את השינוי הזה ושאינה חושבת שזה ישנה את בטיחות המוצר ואת יעילותו. הם חייבים להראות את זה. הדבר הראשון שהם צריכים לעשות הוא בדיקות כימיות, כדי להראות שבבדיקות אין שינוי. שנית, הם חייבים לבצע מחקרים בחיות, שידגימו כיצד החומר מופץ בגוף לאחר שינוי הפורמולציה בהשוואה לפורמולציה הקודמת, ושלישית, צריך לעשות מחקרים קליניים באוכלוסיית היעד. את הבדיקות הכימיות נראה שהחברה עשתה, שכן הם הצהירו שלא שינו את ה-mRNA ואת החיסון עצמו, אלא רק את הבאפר".
ד"ר דיוויד וייסמן: "דמיינו לעצמכם שאתם קונים מכונית חדשה מסוכנות מכוניות, ואז כשאתם מקבלים אותה, המוכר בסוכנות אומר לכם: 'דרך אגב, שינינו את הבלמים. לא בדקנו את הבלמים החדשים, אבל זה שינוי מינורי, אל תדאגו'. האם הייתם קונים את המכונית?"
עד שלא ניתן את החיסון לא נדע
למרבה האבסורד, מתברר שהחברה לא ביצעה כלל מחקרים קליניים על הפורמולה החדשה, ושהמחקר הקליני בילדים בני 5-11 נעשה על הפורמולה הקודמת, זו שמכילה את הבאפר הישן.
ד"ר וייסמן: "בדיון של הוועדה המייעצת של ה-FDA ב-26 באוקטובר פייזר נשאלה באופן ישיר על ידי אחד מחברי הוועדה (ד"ר סטיבן פרגם. י.ש.ר): 'כשעשיתם את המחקר בילדים – האם השתמשתם בגרסת ה-PBS של החיסון (כלומר, בבאפר הישן) או בגרסת ה-Tris (הבאפר החדש)?'. התשובה של ד"ר וויליאם גרובר, שהוא סגן נשיא למחקר ופיתוח קליני של חיסון הקורונה בפייזר, השיב: 'השתמשנו בבפאר הישן במחקר הקליני, לא בחדש'. המשמעות היא שכל מה שאנחנו יודעים על החיסון הזה נעשה כולו עם הבפאר הישן. איננו יודעים מאומה על השפעת החיסון בהרכב החדש. יותר מזה, החברה גם לא דיווחה שביצעה שום מחקר בבעלי חיים".
- אז איך ניתן לדעת האם נערכו מחקרים בבעלי חיים או לא?
"כמי שעבד שנים רבות בתעשיית התרופות בתחום הזה של הגשת מחקרים ל-FDA לצורך קבלת אישורי FDA, אני יכול להגיד שאילו אני הייתי בנעלי פייזר והייתי מדען שהיה מופיע בדיון הזה, הייתי מצפה להישאל על ידי ה-FDA, 'האם עשית מחקר כלשהו, אפילו מחקרים בחיות, כדי לשכנע אותנו או לתת לנו רמת ביטחון כלשהי לגבי הפורמולציה החדשה?'. הייתי מתכונן לזה ומיד הייתי אומר, 'כן, עשינו את המחקר המסוים הזה'. יותר מזה, הייתי מבהיר את העובדה הזו עוד לפני שהייתי נשאל. העובדה שזה לא נאמר מדברת בעד עצמה. זה פשוט לא ייאמן".
מה שמחזק את הטענה החמורה הזו היא העובדה שד"ר גרובר אף הודה בדיון ה-FDA שלחברה עצמה אין אפילו מושג מדוע בדיוק הפורמולה החדשה יציבה יותר. בתשובה לשאלתו של ד"ר פרגם, ד"ר גרובר אמר: "אנו מעדיפים לא לנחש אודות הכימיה בבסיס".
ה-FDA נעדר מהדיון
לדברי ד"ר וייסמן, מה שמדאיג אפילו יותר, הוא שה-FDA לא דרש מהחברה לבצע מחקרים קליניים שיבחנו את בטיחותו של ההרכב החדש, לא בילדים ולא במבוגרים, ואף לא את המחקרים בחיות, ולכל אורך הדיון איש מחברי הוועדה המייעצת לא ניסה אפילו לחקור את אנשי פייזר מדוע לא עשו זאת ומה יכולות להיות ההשלכות של עובדה זו.
"הם פשוט שתקו – נעדרו מהדיון בשאלה החשובה ביותר", הוא אומר. "יותר מזה. ה-FDA ציינו כי הם לא בדקו את הנתונים הגולמיים בניסויים הקליניים של החברה. הם ציינו זאת במפורש. הם היו אמורים לבחון בעצמם את הנתונים, ובמידת הצורך, אף לחזור לרופאים שיצרו את הנתונים הגולמיים ולבדוק אותם. וזה לא שלא היה להם זמן לעשות זאת. הסיפור הזה נמשך כבר שנה וחצי. כשחברת יאנסן הגישה ל-FDA לפני כשלושה שבועות את הנתונים שלהם על חיסון הבוסטר, היה להם מחקר על 40 אלף אנשים. אנשי ה-FDA טענו שהם לא יכולים לבדוק נתונים על כמות כזו כי אין להם זמן משום שאנחנו במצב חירום. מה זאת אומרת שאין לכם זמן? מה חשבתם, שהם יופיעו רק עם 200 משתתפים? לא ידעתם שזה המחקר? ידעתם את זה חודשים. ואז פייזר מופיעים בפניהם עם 2,000 משתתפים - עשירית ממה שהיה ליאנסן, ועדיין ה-FDA לא בדק את הנתונים הגולמיים. הם כתבו במפורש: 'לא אומת על ידי ה-FDA'. זה טירוף".
 |
| ד"ר אריק רובין, העורך הראשי של כתב העת New England Journal of Medicine: "לעולם לא נלמד עד כמה החיסון בטוח עד שנתחיל לתת אותו" |
"אז השאלה מגיעה לנקודה הזו: האם ההצהרה הזו של פייזר, שמדובר בשינוי מינורי מספיקה ל-FDA כדי להסכים איתם? דמיינו לעצמכם שאתם קונים מכונית מסוכנות מכוניות, ואז כשאתם מקבלים אותה, המוכר בסוכנות אומר לכם: 'דרך אגב, שינינו את הבלמים. לא בדקנו את הבלמים החדשים, אבל זה שינוי מינורי, אל תדאגו'. האם הייתם קונים את המכונית? כשחברה עושה שינוי כזה היא חייבת לעשות מערך ניסויים מאוד מוקפד. זה הסטנדרט. זה לא משהו חדש. במיוחד כשאנחנו מדברים על מוצר רפואי שעומד להיות מופץ באופן מסיבי ברחבי העולם ולהינתן למיליוני אנשים, ולא כל שכן כשמדובר בילדים. ה-FDA חייב היה לדרוש את זה. לא יעלה על הדעת שהם לא יעשו זאת. אני לא חושב שאי פעם שמעתי דבר כזה".
יש לציין כי נציגי פייזר טענו בדיון שישנם "לפחות" עוד שלושה חיסונים שבהם נעשה שימוש ב-Tris כבאפר, אך לא פירטו באילו חיסונים. לדברי ד"ר וייסמן, ידוע על שני חיסונים כאלה – אחד מהם הוא החיסון החדש לאבולה, והשני הוא החיסון של חברת מודרנה. לא בטוח שהדוגמה הזו מחזקת את המסקנה שהפורמולה החדשה בטוחה, שכן עוד ועוד מדינות החליטו לאחרונה להפסיק את השימוש בחיסון של מודרנה עבור האוכלוסייה הצעירה בשל הסיכון לתופעות לוואי, בהן שבדיה, דנמרק, נורבגיה, איסלנד ופינלנד.
המסר למשרד הבריאות: דרשו מהחברה לבצע את המחקרים הנחוצים
ד"ר וייסמן היה אחד הדוברים בדיון הפתוח שנערך בוועדת הצט"מ (צוות טיפול במגיפות) של משרד הבריאות בשבוע שעבר בסוגיית האישור של חיסון הילדים הצעירים. הוא הזהיר בדבריו את המשרד כי מידת הבטיחות של החיסון, בוודאי בילדים, עדיין איננה ברורה, וציטט את ד"ר אריק רובין, העורך הראשי של כתב העת New England Journal of Medicine, שבדיון ה-FDA אמר: 'לעולם לא נלמד עד כמה החיסון בטוח עד שנתחיל לתת אותו'.
אתם יכולים להגיד שרופאים וחוקרים כמו ד"ר רוברט מאלון (אחד ממציאי טכנולוגיית ה-MRNA), שעד לא מזמן היו בעיניכם שם דבר, השתגעו לפתע. אבל אתם לא יכולים להתווכח עם ה-FDA, שבעצמו אומר שהם לא בדקו את הנתונים.
"לכן, אני אומר למשרד הבריאות הישראלי: אתם חייבים לבדוק את הנתונים בעצמכם. אתם לא יכולים לסמוך על ה-FDA. מבלי להיכנס לתיאוריות קונספירציה, אתם יכולים להגיד שרופאים וחוקרים כמו ד"ר רוברט מאלון (אחד ממציאי טכנולוגיית ה-MRNA), שעד לא מזמן היו בעיניכם שם דבר, השתגעו לפתע. אבל אתם לא יכולים להתווכח עם ה-FDA, שבעצמו אומר שהם לא בדקו את הנתונים. בצה"ל, כל צנחן יודע היטב שהוא חייב להיות זה שיבדוק את המצנח שלו בעצמו. תארו לעצמכם שצהל יגיד לצנחנים, אתם יודעים מה? אנחנו לא הולכים לעשות את זה יותר. ה-FDA בדק את המצנחים שלכם עבורכם. למרבה הצער, ה-FDA, מי שהיה אמור להיות המשגיח, לא היה שם. אתם חייבים לעשות את זה בעצמכם".
למרות האזהרות שהשמיעו ד"ר וייסמן ומומחים רבים נוספים, צוות הטיפול במגיפות של משרד הבריאות הצביע בשבוע שעבר לאשר את מתן החיסון לילדים הצעירים, כאשר האישור כולל גם חיסון ילדים מחלימים.
בואו להשפיע עוד היום
"מגזין זמן אמת" הוא אתר תקשורת שהוקם כדי לספק את מה שחסר כל כך במדיה – עיתונות אחרת, מעמיקה, המייצרת תוכן איכותי, שכולל תחקירים, סקירות ומאמרי עומק, ופועלת מתוך תחושת שליחות וללא אינטרסים מסחריים או פוליטיים, בתמיכת הציבור הרחב.
תגובות לכתבה זו יועברו לאישור לפני פרסום. אנא השתמשו בשפה מכבדת ואם מצאתם טעות, אנא צרפו נימוק ענייני וקישור למקור הטענה.


ממליצים לא לחסן ילדים
מה צריך לעשות כשדוקטורית בתקשורת – לא דוקטורית ברפואה
פרופסור לניהול תפעולי – לא פרופסור לרפואה, מנהל מחלקה בבית חולים
דוקטור לסוציולוגיה ולאנתרופולוגיה – לא דוקטור וירולוג ואפילו לא סטטיסטיקאי
ממליצים לא לחסן ילדים
אני לא יודעת מה אתם הולכים לעשות, אבל אני הולכת לחסן את כל הילדים שלי


שאלה לצוות האתר
לפי מה שהבנתי (ממקור אחר ) אותם חלקיקי הננו נמצאים בתוך חומר שהימצאותו בחיסונים מוסתרת ''גראפן אוקסיד'' זה חומר רעיל שהוא תחמוצת מתכתית בעלת מוליכות על חשמלית , (ראיתי פה באחת הכתבות גם תזכורת לחומר וזה נעלם ?) גם שינוי החומציות וגם שינוי מאזן האלקטרוליטים בדם יכולים להיות קשורים לחומר הנ''ל ? האם אתם בודקים או בדקתם את סיפור החומר הזה ?https://bit.ly/2UVaRSA

יפה יקרה, ברוכה תהיי, תודה!
החצי השני המתבקש מדבריו של ד"ר אריק רובין:"לעולם לא נלמד עד כמה החיסון *קטלני* עד שנתחיל לתת אותו."
התנהלות נפשעת לכאורה, מצערת, מפחידה, של השלטונות.
תודה ענקית לך, יפה, על האומץ, היושרה, המקצועיות, והמחויבות הסיזיפית להאיר ולהעיר.
נקווה שהצדיקים המעטים - ואת ביניהם - יצילו את סדום ועמורה מפורענות. אמן.



Report

מחקר: הניסויים הקליניים שהובילו לאישור הפרוזאק לילדים ובני נוער העלימו מקרים של ניסיונות התאבדות לאחר נטילת התרופה
היא כונתה "תרופת האושר" והפכה לנוגד הדיכאון הנפוץ ביותר בשימוש בשנות ה-80. אבל ניתוח מחודש של הנתונים חושף שילדים ובני נוער שהשתתפו במחקרים שהביאו לאישור ה-FDA לתרופה לגילאים אלה ניסו להתאבד לאחר נטילתה - אך אירועים אלה הושמטו מהפרסומים בכתבי העת הרפואיים

משרד הבריאות הסתיר מהצט"מ את המחקר שהצביע על סיכון מוגבר לתופעות לוואי מחיסון פייזר בילדים קטנים
ממצאי המחקר, שהצביעו על כמות כפולה עד פי 4 של דיווחי תופעות לוואי בילדים הקטנים, הוסתרו לא רק מהציבור - אלא גם מהצט"מ. כתוצאה מכך, הקונצנזוס בין חברי הצט"מ בדיון על אישור החיסון לתינוקות היה: "החיסון בטוח לתינוקות". ד"ר בועז לב, ראש הצט"מ, שיודע בדבר המחקר על ידי עמותת 'החזית המקצועית לאתיקה', אמר: "ברמת הבטיחות אני מאמין לגמרי בחיסון ומרגיש חופשי להמליץ"

ה-FDA מתעלם מעשרות מקרים של תופעות לוואי חמורות ורב-מערכתיות בתינוקות – וטוען שפייזר הוכיחה שהחיסון שלה בטוח
במסמך סקירה של נתוני הבטיחות והיעילות של חיסון פייזר שפרסם היום ה-FDA לקראת הדיון בהרחבת היתר החירום לתינוקות, טוענת הרשות האמריקאית שהחיסון יעיל ובטוח. אלא שטענת היעילות נסמכת על 10 מקרים בלבד של תסמינים, ואילו טענת הבטיחות מתעלמת מעשרות דיווחים חמורים ומסכני חיים

חשיפה: פייזר ידעה שמחלימים לא זקוקים לחיסון, ושהחיסון מגביר סיכון לתחלואה בימים הראשונים
כך עולה ממסמכים חדשים של פייזר, ששוחררו השבוע במסגרת הסבב השני של גילוי המסמכים שכפה בית המשפט על ה-FDA. כמו כן, מתברר שהחברה ידעה שתופעות הלוואי חמורות יותר בצעירים, ושהסיכון למיוקרדיטיס גבוה בהרבה מכפי שנטען

האלגוריתם אשם? ה-CDC הסיר בחשאי רבע ממקרי המוות בילדים שיוחסו לקורונה
ה-CDC הסיר מאתר מעקב הנתונים שלו עשרות אלפי מקרי מוות המיוחסים לקורונה, בהם כ-25% ממקרי המוות בילדים. הנתונים המנופחים שימשו את ה-FDA כדי להצדיק את מתן היתר החירום לחיסון הילדים. לטענת ה-CDC: חלה טעות – האלגוריתם אשם

החיסון בטוח בהריון? 87.5% מההריונות בדוח של פייזר שתוצאתם דווחה הסתיימו במות העובר. המחקר בחיות מצא שיעור הפלות כפול בחולדות שחוסנו ועיוותים בשלד העוברים
הממצאים החמורים נחשפו במסמכים ששחררו ה-FDA ורשות הבריאות באוסטרליה, ומראים שפייזר וה-FDA הסתירו את המידע. הממצאים בבעלי חיים "טואטאו", וסיווג החיסון שונה ל"בטוח בהריון"
בואו להשפיע עוד היום
"מגזין זמן אמת" הוא אתר תקשורת שהוקם כדי לספק את מה שחסר כל כך במדיה – עיתונות אחרת, מעמיקה, המייצרת תוכן איכותי, שכולל תחקירים, סקירות ומאמרי עומק, ופועלת מתוך תחושת שליחות וללא אינטרסים מסחריים או פוליטיים, בתמיכת הציבור הרחב.












